| 結核菌パネルテストスライド作製と喀痰塗抹検査の精度管理に有用な抗酸菌を含んだ人工痰の調製法の検討 |
(International Journal of Tuberculosis and Lung Disease vol.10 (8) : 899-905, 2006. に掲載された論文の概要を日本語に訳したものです。)
山田博之1)、御手洗聡1)、Lucy Aguiman2), 松本宏子3)、藤木明子3)
1) 財団法人結核予防会結核研究所 抗酸菌レファレンスセンター細菌検査科
2) Cebu Regional Tuberculosis Reference Laboratory, Center for Health Development, Cebu, Philippines.
3) 財団法人結核予防会結核研究所 研究部 精度管理プロジェクト
背景
WHOの統計(2003年)によれば、全世界で年間約900万人が結核に感染し、約400万人が塗抹陽性であると報告している(1)。 喀痰塗抹標本の顕微鏡による検査は結核患者を発見するための迅速かつ有効な方法である(2-4)。WHOは世界の結核対策の目標として、塗抹陽性例の70%を発見し、更にその85%を完治することを提唱している。結核患者の有効な発見のためには、塗抹検査の質を保証することが必須である。結核菌を含む抗酸菌 (acid-fast bacilli、AFB) の外部精度管理 (External quality assessment, EQA)にはパネルテスト (Panel testing)、ブラインド再チェック (Blinded re-checking)、そして現場での評価 (on-site evaluation)の3つの方法がある。パネルテストはブラインド再チェックプログラムに先立って行われ、検査室の技量に関する基本的なデータを収集するのに役立つ(5)。この方法は検査技師たちの抗酸菌塗抹標本鏡検技術を評価するものである。実際、染色済み、および未染色の塗抹標本を末端の検査施設に送り、検査技師の染色および鏡検能力を評価するが、喀痰の採取、塗抹標本の作製、結果の報告などの日常業務については評価の対象外である。
パネルテストスライドを作るための方法がすでに2つ報告されており、いずれも抗酸菌陽性および陰性の喀痰を患者から集め、それらをNaOHあるいは、N-acetyl-L-cystein (NALC)で処理するものである。これらの方法は、簡便で時間のかからない方法であるが、いくつかの欠点もある。第一に、パネルテストスライドを作製するためには塗抹標本に含まれる菌量の違いにより5段階のグレードの作成が求められる。そのために、多量の抗酸菌を含む強陽性痰由来サンプルの希釈に用いる抗酸菌を全く含まない完全な陰性痰由来サンプルが必要である。しかし完全な陰性痰を収集すること、そしてそれが完全に陰性であることを証明することは極めて困難である。第二に、第一の問題ともからむが、3+から±までのグレードの塗抹標本を作製するためには抗酸菌が大量に存在する強陽性喀痰が必要であるが、それらを扱う操作は、バイオハザードの観点から極めて危険である。第3に、抗酸菌陽性喀痰で調製された塗抹標本はグレードの元になるサンプルに含まれる菌量の標準化が困難である。最後に、NaOHあるいはNALC法で作製された塗抹標本は外見上も鏡検下においても実際の喀痰の塗抹標本とは大きく異なっており、一見して、人工的なものであることが判明してしまう。
したがって、パネルテストに利用できる塗抹標本を作製するための新しい方法を開発することが望まれている。今回ここで報告する方法では、容易に入手可能で、バイオハザードの問題がなく、一貫した抗酸菌陽性率を与えることが可能な材料で塗抹標本の作製が可能である。新しい方法では、培養細胞と毒力のない抗酸菌とポリアクリルアミドゲルを使って、人工痰を調製した。この人工痰は塗抹標本検査の外部精度管理と技師のトレーニングにおいて大きな貢献が期待される。
材料と方法
パネルテスト用塗抹サンプルの調製
I. NaOH法とNALC法:
結核予防会複十字病院および国立病院機構東京病院から採取された患者由来の抗酸菌強陽性喀痰と抗酸菌陰性喀痰を採取蓄積し、Azizらにより記載された方法に従い(5)、図1の手順でNaOHまたは、NALCで処理して塗抹用標本を作製した。NaOH法ではNaOH処理は56-60℃で30分加熱処理した。
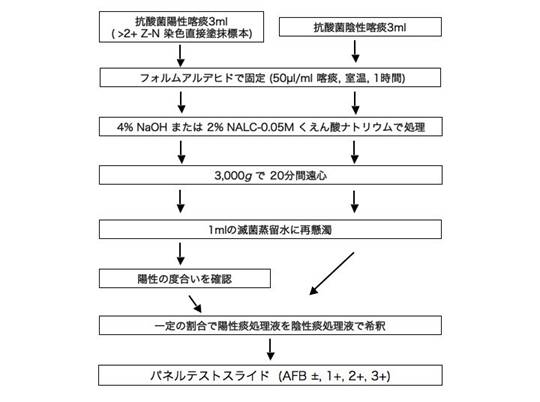
図1. 患者喀痰を用いた塗抹用サンプル調製法(NaOH法とNALC法)
II. メチルセルロース法とポリアクリルアミド法:
(i)細胞の調製:ヒト単球由来のTHP-1細胞は150cm2のフラスコ5個で10% ウシ胎児血清, 2 mM L-glutamine, penicillin (100 U/ml), streptomycin (100 μg/ml)含有RPMI1640で約3週間から4週間培養後、遠心して、pore size 0.2μmの親水性フィルターで濾過した0.1Mリン酸緩衝液(PB, pH.7.4)で3回洗浄、遠心を行った。フラスコ1個分の細胞を最終的に1本の遠心管に集める。最後のペレットは、上清を捨てた後、安全キャビネット内で遠心管を傾倒して余剰の水分を蒸発、乾燥させる(5分から10分)。
(ii)菌の調製:M. bovis BCG Pasteurは7H9液体培地で約2週間培養し、OD = 0.7程度になったところで、Acrodisk filter (#4650, pore size 5.0 μm, Pall Corporation, Cornwall, UK) で濾過し、ろ液を1%小川培地に接種、4週間後にCFUをカウントし、5×107 CFU/ml以上の菌濃度であることを確認してから用いる。5×107 CFU/ml以上の菌濃度の菌液が得られたら、これを原液として3+用の菌液として用い、冷PBで10倍希釈し2+用の菌液として5×106 CFU/mlの菌液を調製し、更に10倍希釈系列で、5×105 CFU/ml の菌液を1+用とし、再度10倍希釈して5×104 CFU/mlの菌液を±用とした。各希釈液は氷上に置き、菌塊が生じるのを防いだ。
これらの菌液を上述した乾燥した細胞にそれぞれのグレードの菌液を250μlずつ加え、ピペットでよく攪拌する。陰性用サンプルは上記PBを250μl加え、よく攪拌する。
(iii)メチルセルロース(MC)法:元来、培養技術の精度管理にために考案されLaboratory Services in Tuberculosis Control Part I: organization and management (6)に記載された方法を参考にした。2%のメチルセルロース水溶液をあらかじめ調製しておき、これを各遠心管に菌液またはPBと等量加え、再度よく攪拌する。暫く室温で放置すると徐々に粘性が現れる。
(iv)ポリアクリルアミド(PAM)法:上記メチルセルロース法でのメチルセルロースの代わりにポリアクリルアミドを用いる点が異なる。ポリアクリルアミドは22.2 gアクリルアミド, 0.6 g N, N’-メチレンビスアクリルアミドを100mlの蒸留水に溶解し、これを原液として、遮光して4℃で保存した。ポリアクリルアミドの調製は、この原液1.75mlに、0.2μmフィルターで濾過した蒸留水6.25ml、同じく0.2μmフィルターで濾過した5×TBE 2ml、直前に調製した10%ペルオキソ二硫酸アンモニウム(過硫酸アンモニウム)を加え、よく攪拌し、氷上に置く。前記の細胞・菌混合液が調製できたところで、重合加速剤であるN, N, N’, N’-tetramethylethylenediamine (TEMED)を8 μl加えよく攪拌する。速やかに、細胞と菌の混合液に菌液と同量(ここでは250μl)のポリアクリルアミドを加え、十分に攪拌する。1-2日実験台の上で通常の光(昼間の間接太陽光または室内照明)が当たる状態で放置すると粘性と曳糸性を持ったサンプルができる。
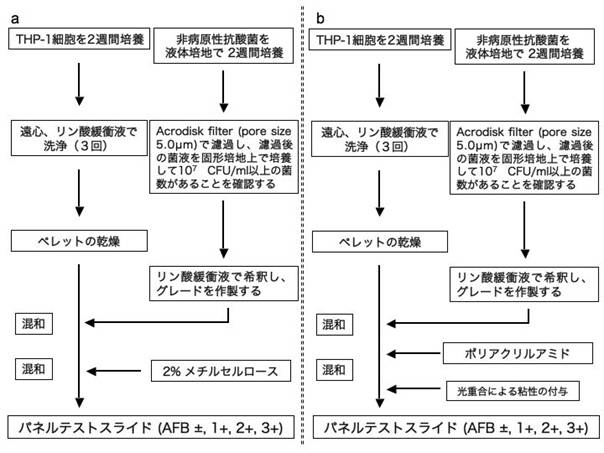
図2.メチルセルロース法(a)とポリアクリルアミド法(b)のサンプル調製手順
染色および鏡検
これらの塗抹用サンプルをスライドグラスに塗抹し、Ziehl-Neelsen染色および蛍光染色を行い、対物油浸レンズ100倍、あるいは40倍レンズで鏡検し、染色性、細胞、菌の様相、陽性グレードにおける一貫性などを検討した。
結果
今回調製した4種類のパネルテスト用塗抹サンプルおよび塗抹標本の肉眼所見を図3に示す。
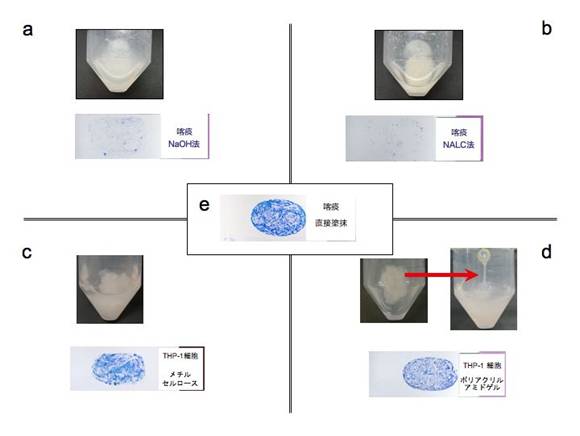
図3. 4種類の塗抹用サンプルおよびその塗抹標本の肉眼所見
NaOH法とNALC法で作製された塗抹用サンプルは、作製が簡便で、塗抹作業も容易であるが、最終産物には粘性がなく、菌を含む細胞成分の沈渣が粉末状であり、塗抹に際しては塗り重ねることが難しく、濃度が薄くなる(図3a, b, e)。そのため、これらの塗抹標本は喀痰の直接塗抹標本とは異なり、細胞成分がほとんどで、繊維状成分に乏しい(図4)。
これに対して、メチルセルロースを用いた人工痰の作製は簡便であるが、混合液の粘性が弱く、その塗抹標本の肉眼的所見は実際の喀痰直接塗抹標本と大きく異なっていた(図3c)。 しかし、PAMを用いた人工痰は、実際の喀痰と粘度が類似しており、Z-N染色後の肉眼所見は実際の患者喀痰との区別が困難であった(図3d)。
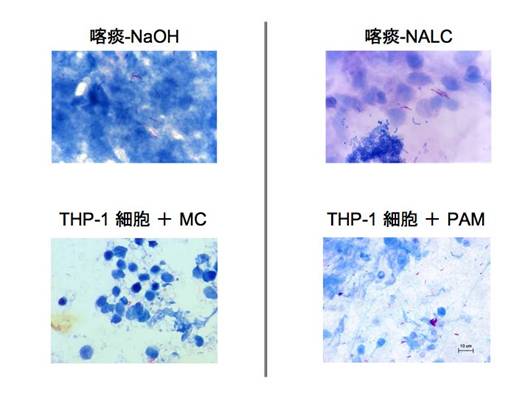
図4. 4種類の塗抹標本の顕微鏡所見 (Z-N染色)
図4にこれらの塗抹標本の顕微鏡所見を示した。NaOH 法と NALC法による塗抹標本は細胞と抗酸菌が観察されるが、線維状物質は実際の喀痰塗抹標本と比較して少なかった。他方、MC法とPAM法で作製された塗抹標本ではより多くの線維状成分が細胞や抗酸菌と共存しているのが観察された。特に、PAM法で作製された塗抹標本の染色性は、実際の喀痰塗抹標本に匹敵する特性を有し、Z-N染色のみならず、auramine Oとrhodamine Bによる蛍光染色でも良好な結果を示した(図5)。
NaOH法, NALC法、MC法、PAM法のサンプル作製方法とその特性を表1にまとめた。既に述べたように、PAM法は他の方法より実際の抗酸菌陽性、陰性の喀痰を要求しない点、最終産物の肉眼所見、顕微鏡所見が実際の喀痰の直接塗抹標本と極めて類似している点において、他の方法より優れていると考えられる。さらに、塗抹標本の100視野あたりの陽性度も一貫していた。
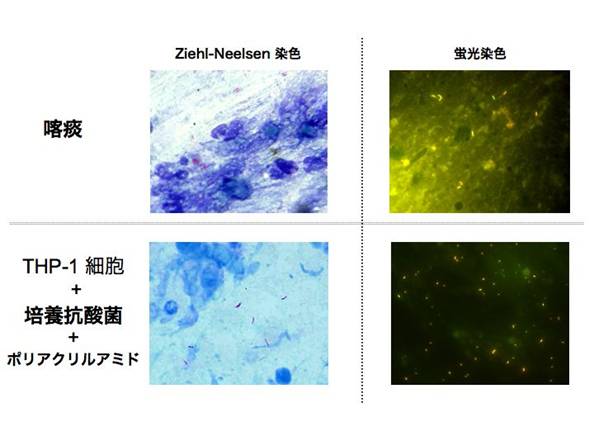
図5. 実際の患者喀痰直接塗抹標本とPAM法により作製した人工痰の染色特性
(Z-N染色と蛍光染色)
表1. NaOH, NALC, MC, PAM 法による人工痰の特性の比較
| NaOH法 | NALC法 | メチルセルロース (MC)法 |
ポリアクリルアミドゲル (PAM)法 |
|
| 材料 | 抗酸菌陽性(2+, 3+)と 陰性喀痰 | 抗酸菌陽性(2+, 3+)と 陰性喀痰 | 培養細胞とMC | 培養細胞とPAM |
| 抗酸菌 |
喀痰中の 強毒臨床株 |
喀痰中の 強毒臨床株 |
培養弱毒株 | 培養弱毒株 |
| バイオハザードレベル |
材料: 低 塗抹標本: 無し |
材料: 低 塗抹標本: 無し |
無し | 無し |
| 菌量の調節 | 困 難 | 困 難 | 容 易 | 容 易 |
| 肉眼的所見 (%) a | ||||
| 大きさ | 100 | 100 | 100 | 100 |
| 厚さ | 50 | 50 | 80 | 100 |
| 均一性 | 100 | 100 | 80 | 100 |
| 染色性 | 80 | 80 | 80 | 100 |
| 顕微鏡所見 | 主に細胞 | 主に細胞 | 細胞と 粘液様成分 |
細胞と 粘液様成分 |
| 粘性 | 無 し | 無 し | 中程度 | 高 い |
| 患者喀痰との全体的な類似性 | 低 い | 低 い | 低 い | 高 い |
| 再現性 | 低 い | 低 い | 中程度 | 高 い |
| パネルテストスライドの品質管理 | 困 難 | 困 難 | 容 易 | 容 易 |
| パネルテストスライドとしての適合性 | 低 い | 低 い | 低 い | 高 い |
考察
パネルテストが高頻度に利用されない主な原因は、適切な標本を得ることが困難であることである(5)。今回の研究の目的は、容易に入手可能な材料を用いて人工痰を作製することにより、問題を克服することにあった。
既に発表されていたNaOH法とNALC 法は簡便で容易であるが、患者由来の抗酸菌(結核菌)陽性喀痰を必要とする(5)。 これらの喀痰には生きた結核菌が含まれており、固定前はバイオハザード上の問題が残る。また、もう一つの重要な問題として、陽性のグレードを作るために陽性喀痰サンプル液を希釈するための抗酸菌陰性痰を大量に必要とすることがあげられる。さらに、これらの方法で作製された塗抹標本は粘性を失い、線維状物質も少なくなっていた。また、類似した標本を得るための再現性にも乏しいと考えられる。
他方、MC法、PAM 法にはいくつかの優れた点がある。例えば、培養によって得られる毒力のない抗酸菌を用いるので、バイオハザードの問題がない。さらに、これらの方法は蓄痰の必要がなく、あらかじめ調製した菌は凍結保存できるので、パネルテストスライド作製の注文が出されてから約3 - 4週間で調製できる点が便利である。加えて、菌数の調整が容易であるので、塗抹標本の特性に高度な再現性がある。
メチルセルロースは元々、抗酸菌培養技術の熟練度を評価するために導入された人工痰標本である(6)。今回の研究では、塗抹検査のパネルテストスライドのための人工痰材料としてMCを用いた。MC、THP-1細胞、抗酸菌の混合液は粘性のあるサンプル液を作ることができたが、これを用いた塗抹標本は肉眼的、顕微鏡的に実際の喀痰塗抹標本とあまり類似していなかった。
PAM法はさらにいくつかの優れた特長が認められた。まず、構成成分を均一に混合する時点ではサンプル液に粘性がなく、調製後、光重合により徐々に粘性が与えられることである。また、Z-N染色前後の塗抹標本の肉眼所見および細胞成分と線維状成分が混在する顕微鏡所見は実際の喀痰塗抹標本と類似している。さらに、この方法で調製した塗抹標本はZ-N染色と蛍光染色の両方に染色適応が可能である。また、PAMを用いたパネルテストスライドを作製するのに必要な経費は、染色にかかる費用を除いて、上記の方法で100枚作るとして、概算で1枚あたり約100円から150円であった。
アクリルアミドのモノマーが有毒であることはよく知られているが、PAM法を行うにあたって、技師は通常用いる手袋やマスク以外に特別な装備を必要とせず、調製に関するどのステップも安全キャビネット内で作業することができる。さらに、PAMの主な構成成分であるアクリルアミドとメチレンビスアクリルアミドの混合液は100ml以上の容量で作製可能であり、一度に用いる混合液の量はわずか1.75mlで他の成分と混合して10mlのPAMを調製できる。もし、この10mlのPAMをすべて使えば計算上2000枚(パネルテスト200セット分)の塗抹標本を作製可能であり、有害な物質に曝露される頻度は極めて低いと考えられる。 さらに、WHOの Supranational Reference Laboratory (SRL) がこれを調製し、国レベルあるいは末端の検査室へ送付することもできる。この手順はより簡便であり、末端検査室の不慣れな技師が有害な試薬に接する機会もより少なくなるであろう。末端検査室の技師がSRLあるいは国レベルのレファレンスラボで調製され、送付されたPAM混合液を使って塗抹標本の作製のみを行えば、有害な試薬との接触に関する問題は皆無に近くなるであろう。
もう一つの重要な点は、塗抹標本のconsistency(陽性グレード内の抗酸菌数の安定性)である。パネルテストスライドは、3+(20視野以上で11個以上の抗酸菌が観察される), 2+(50視野以上で1-10個の抗酸菌が観察される), 1+(100視野で10-99個の抗酸菌が観察される), ±(100視野で1-9個の抗酸菌が観察される)、-(100視野で全く抗酸菌が観察されない)の5つのグレードを含む必要がある。この要件を満たすために、今回我々は、抗酸菌をMiddlebrook 7H9液体培地で約2週間培養し、これをAcrodisk filter (5.0 μm pore size) で濾過することにより、菌塊を除去して、単個菌に近い状態の菌液を得た。Toman はその著書で、平均1視野あたり1個の抗酸菌が検出される(2+に相当)ためには1mlあたり106 の抗酸菌を含む喀痰が必要であることを報告している(8)。他方、油浸レンズで100視野観察して、1個の抗酸菌が観察される(±の標本に相当)には喀痰1mlあたりおよそ104 の抗酸菌が存在することが明らかにされている。今回の研究では、3+の標本を作製するために107 CFU/ml以上 の菌液を用い、この3+用の菌液を10倍希釈系列で希釈することにより、1mlあたり106, 105 and 104 抗酸菌を含む2+、1+、±のサンプル液を調製することができた。これらの値は、Tomanの報告(8)と一致するものである。最後に、我々の人工痰塗抹標本は各グレードにおける抗酸菌数に高い一貫性を有しており、これは材料と作製方法における単純性と再現性によるものと考えられる。
今回、我々が考案した新規人工痰は作製方法が簡便であり、また、良好な再現性を有していた。この方法では、大量の抗酸菌強陽性の喀痰、陰性喀痰を必要とせず、バイオハザード的にも安全で、長期保存も可能であることが示された。この方法で作製された塗抹標本はパネルテストのみならず、検査技師のトレーニングにも有用なものと考えられ、多くの領域での応用が期待される。また、将来、塗抹スライド作製の機械化が検討されることがあれば、実際の喀痰の代わりに利用可能であり、装置の試作に当たって、バイオハザード対策を施す必要がないということは大きな利点であろう。
参考文献
1. World Health Organization, 2005. WHO media center, Fact sheet No.104, 2005. [Online] http://www.who.int/mediacentre/factsheets/fs104/en/index.html
2. Lan, N. T. N., Wells, C. D., Binkin, N. J., Becerra, J. E., Linh, P. D., and Cô, N. V. Quality control of smear microscopy for acid-fast bacilli: the case for blinded re-reading. Int. J. Tuberc. Lung Dis., 1999; 3: 55-61.
3. Martinez-Guarneros, A., Balandrano-Campos, S., Solano-Ceh, M. A., et al. Implementation of proficiency testing in conjunction with a rechecking system for external quality assurance in tuberculosis laboratories in Mexico. Int. J. Tuberc. Lung Dis., 2003; 7: 516-521.
4. Tuberculosis Division. Tuberculosis bacteriology-priorities and indications in high prevalence countries: position of the technical staff of the Tuberculosis Division of the International Union Against Tuberculosis and Lung Disease. Int. J. Tuberc. Lung Dis., 2005; 9: 355-361.
5. Aziz, M. A., Ba, F., Becx-Bleumink, M., et al.: External quality assessment for AFB smear microscopy. Association for public health laboratories. 2002; pp 1-111.
6. de Kantor, I. N., Kim, S. J., Frieden, et al.: Laboratory services in tuberculosis control. Organization and management Part I. WHO, 1998; pp 42-43.
7. Fujiki, A.: AFB microscopy training. The Research Institute of Tuberculosis, Tokyo, Japan, 2005; pp16-23.
8. Toman, K.: Tuberculosis case-finding and chemotherapy. Questions and answers. WHO, 1979; pp 6-7.
updated 2006/8/4