|
1.はじめに
結核症は結核菌(Mycobacterium tuberculosis)の感染により引き起こされる慢性的感染症である。
現在、日本において結核症は既に過去の感染症という認識が一般的であるが、世界的に見ると結核症は感染症の中でも
主要な死亡原因である。先進国では過去、結核の感染例は低下の一途を辿ってきたが、現在その低下率は鈍化傾向にある。
これは、開発途上国では依然として結核が蔓延しており、これらの国からの移民により持ち込まれる場合もあり、さらに
結核そのものに対する関心が薄れ、管理が不十分になってきていることも一因である。現在、およそ全世界人口の1/3が結核菌に
感染しており、そのうち約10%に発症の危険がある。また、結核症により年間全世界で約三百万もの人が死亡している。
一方、感染した中の約90%が結核症には至らず、結核菌に対して抵抗性を示すが、この結核菌に感染した際に獲得される抵抗性は、
主にマクロファージとT細胞から構成される典型的な細胞性免疫である。従って、AIDSのような免疫不全、あるいは老齢などにより
免疫力が低下すると、この結核菌に対する抵抗性が弱まり結核症の発症に至る。また、結核症の治療は、抗生物質および化学薬剤の
投与によりなされているが、これら薬剤に抵抗性の結核菌が出現して来ている。このように、結核というのは過去の感染症ではなく、
将来再び人類の脅威になる可能性を秘めている。
結核症は前述のように、慢性感染症であるが、この成立には結核菌に対する宿主の免疫反応、特に細胞性免疫反応が大きく関与している。
本総説では、結核に対する生体の防御機構を、最近遺伝子クローニングされたサイトカインであり細胞性免疫の誘導において極めて
重要と考えられているインターロイキン(IL)-12を中心に述べ、これらの知識を今後どのように結核対策に応用可能かを考察したい。
2.結核研究の歴史
結核症の原因となる結核菌は、1882年に初めてKochにより、肉芽腫における巨大細胞内に発見された1)。
彼はさらに抗結核ワクチンを作製することを試み、結核菌培養上清を熱処理後グリセリン抽出物(ツベルクリン)を調製し、
結核菌に感染したモルモットに皮内注射したところ、注射部位と感染部位とに激しい壊死が起きた(コッホの現象)2)。
彼はツベルクリン中にこの遅延型過敏反応を引き起こす物質が存在すると考え、ツベルクリンを結核患者の治療に使用することを
試みたが成功しなかった。しかし、その後結核症の診断法としてツベルクリン反応は広く受け入れられ、現在ではより精製度の
高いPPD(tuberculin purified protein derivative)が使用されている。
一方、当時弱毒生菌をワクチンとして使用し、その病原菌の感染に対する抵抗性が得られることが知られていたことから、
ウシ結核菌株(M. bovis)を弱毒化するため1908年にパスツール研究所のCalmetteとGuerinは継代培養を始めた。そして、
1919年に230代まで継代した菌株は種々の動物に対し無毒であることが確認され、1921年に始めて人間に投与された。
1921年から1927年までに969人の乳児にこのCalmetteとGuerinにより樹立された弱毒ウシ結核菌株(bacilli Calmette Guerin, BCG)が
ワクチンとして投与され、BCG投与群の死亡率は3.9%、非投与群では32.6%と非常に良い結果が認められた3)。
そのため、BCGは現在世界中で抗結核ワクチンとして広く使われている。しかしながら、その効果に関する判定は、
その後詳細に検討されたにもかかわらず明確にはされていない。
結核に対する生体防御機構を解析する研究面においては、1900年代初頭細菌毒素に対する免疫が免疫動物の血清を投与する
ことにより他の動物に移入できることが知られており、抗結核免疫も血清投与により結核菌未感染動物に移入する努力が払われたが、
成功しなかった。結核に対する遅延型過敏反応が細胞により移入可能であることが始めて示されたのは、1909から1910年にかけてであるが、
その後Chaseにより、結核に対する遅延型過敏反応の移入が細胞に依存していることが明確に報告された4)。これらの発見を機に
細胞性免疫学が始まり、免疫学の発展に伴いこの抗結核免疫の主体を成すものは、マクロファージとT細胞であること、
さらに最近の分子生物学の目覚ましい発展により、免疫反応が分子あるいは遺伝子レベルで解析することが可能になったため、
これらの細胞が免疫系細胞により産生されるサイトカインと呼ばれる極微量で作用を発揮する生理活性物質により制御されていることが
明らかになってきた。このように、現在抗結核免疫の機構を分子レベルである程度説明可能になってきているが、
完全な理解までにはまだ時間を要するだろう。一方、結核菌自体の遺伝子解析も徐々に進んで来ており、
この宿主側と菌側からの解析の結果得られる知識が将来結び付き、新たな抗結核対策につながる概念が導き出されることが期待される。
3.抗結核機能におけるマクロファージの役割
1)マクロファージの抗結核活性
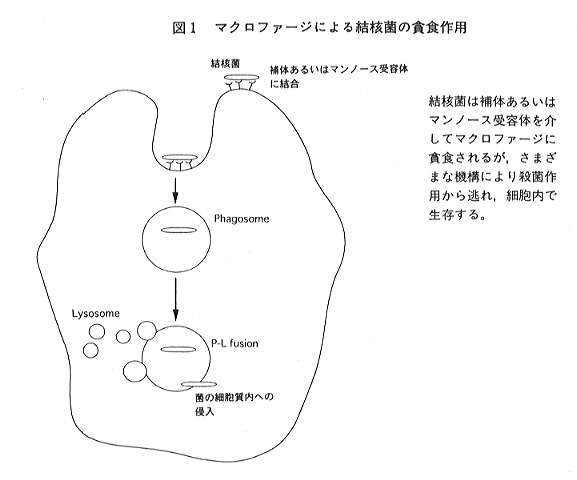
一般的に細菌が生体に感染した場合、細菌はマクロファージにより貧食され、マクロファージ内で細菌を含んだ食胞
(Phagosome)と種々の殺菌性蛋白質を含むリソソーム(Lysosome)とが融合(P-L fusion)し、貧食された細菌は殺菌、消化される。
結核菌も補体受容体5)やマンノース受容体6)を介しマクロファージ内に貧食されるが、結核菌は典型的な細胞内寄生菌であり、
マクロファージ内に貧食された後も細胞内で生き残ることが可能である(図1)。この結核菌のマクロファージによる貧食に対する
抵抗性の機構としては多くの説が提唱されている。結核菌は多量のアンモニアを産生するが、このアンモニアがP-L fusionを阻害する
可能性が示唆されている7)。これに加えて、塩化アンモニウムがリソソームの移動を抑制し、またリソソーム内をアルカリ化すること
によりリソソーム内の分解酵素の作用を抑制することも報告されている8)。このように、多量のアンモニア産生という結核菌の性質が
リソソームによる結核菌の殺菌、消化を多いに阻害していると思われる。その他、結核菌由来のP-L fusionを阻害する物質として、
結核菌体膜成分の糖脂質であるsalfatidesが示唆されているが9)、議論の余地もあり不明確である。
|
図1 マクロファージによる結核菌の貪食作用 |
 |
一方、マクロファージが活性化されるとP-L fusionが促進され、その内部で高い殺菌作用を持つ活性酸素(Reactive Oxygen Intermediate, ROI)が産生される。
このROIの抗結核菌活性に対する評価は依然明確ではないが、結核菌はこのROIに対しても幾らかの機序により抵抗性を持つ。
まず結核菌の産生する酵素であるSOD(superoxide dismutase)およびcatalaseによるROIの失活が考えられている。
また結核菌体膜成分であるphenolicglycolipid I(PGL-I)10)、salfatides11)およびlipoarabinomannan(LAM)12)がROIに対し
抑制的に作用することが報告されている。
ROIに加えて1990年代に活性化マクロファージの殺菌作用にとって非常に重要であると考えられる機構が報告された。
それは、L-arginineを基質とする活性化マクロファージにおいて発現が誘導される誘導型NO合成酵素
(inducible nitric oxide synthase, iNOS)により産生される酸化窒素(Nitric oxide, NO)およびその関連物質
(Reactive nitrogen intermediate, RNI)である13)。しかしながら、ヒトマクロファージ系ではRNIの抗結核菌活性における
重要性は確立されていない。この相違は、iNOSを誘導する際、マウスとヒトのマクロファージでは活性化に対する要求性が異なっている
可能性が考えられる。あるいは、ヒトの系においては、マクロファージに抑制的に作用するサイトカインが優位に働いているのかも
知れない。いずれにせよ、ヒトの系での抗結核菌活性におけるRNIの重要性とiNOSの誘導機構を明らかにすることは、結核菌と
マクロファージの関係を知る上で非常に重要であり、これらのことを通して新たな結核治療法の開発につながる可能性もある。
一方、P-L fusion後のこのような一連の殺菌作用から逃れる手段の一つとして、マクロファージ内での結核菌の食胞から細胞質への
侵入が示唆されている。この機構としてKingらにより報告されたhemolysinがこの侵入に関与している可能性が考えられている14)。
いずれにせよ、この侵入機構に関与する結核菌遺伝子の解析が進めば、このような遺伝子を不活化することにより、
より毒力の弱いリコンビナント結核菌を作製し、抗結核ワクチンとして利用できるかもしれない。
2)サイトカインとマクロファージの活性化
通常、マクロファージは活性化されないと細胞内での殺菌作用は低い。マウスのマクロファージが、免疫学的に刺激された
リンパ球の培養上清により活性化され、様々な抗結核機能を発揮することが知られていたが、遺伝子工学の発展に伴い
サイトカインの遺伝子がクローニングされるようになると、免疫学的に刺激されたリンパ球の培養上清に存在するマクロファージを
活性化する作用の多くがNK細胞あるいはT細胞が産生するインターフェロン-ガンマ(interferon-g, IFN-g)で説明できることが
判明した。その後さらに多数のサイトカイン遺伝子がクローニングされてくるに従い、マクロファージを活性化しうる
サイトカインはIFN-g以外にも数種類あることが認められた。これらは、活性化マクロファージにより産生される
IL-1、IL-6、TNF-aを含む。特にTNF-aはIFN-gと共に作用し、前述のiNOS発現誘導にとって重要なサイトカインである。
このように、IFN-gで活性化されたマクロファージがさらに自己を活性化するサイトカインを産生し、活性化が亢進することになる。
一方、マクロファージの機能を抑制するサイトカインも知られている。それは、後述するTh2細胞が産生するIL-4、IL-10、TGF-b1等であり、
生体内ではこれらサイトカインの微妙なバランスによりマクロファージの機能が調節されていると考えられている。
4.抗結核免疫におけるT細胞の機能
胸腺由来の免疫系細胞であるT細胞は、細胞表面上に発現している特異的な抗原により幾つかの群に分類されうる。まず、
抗原を認識するT細胞受容体(T cell receptor, TcR)の構築様式から、a/bT細胞とg/dT細胞とに分類されている。a/bT細胞は、
全T細胞の約90%を占め、免疫調節の主要な役割を担っている。一方、g/dT細胞は残り約10%を占め、その存在場所もa/bT細胞とは異なり、
主に体表付近に存在している。g/dT細胞の機能は、現在のところ明らかではないが、 その体表付近という存在場所から抗原特異的
a/bT細胞による免疫成立以前の感染初期防御に関与していると考えられている。a/bT細胞とg/dT細胞の抗結核免疫に対する機能は、
これらの細胞をノックアウトしたマウスを用いて解析された。その結果、抗結核免疫は主にa/bT細胞が担うが、g/dT細胞も補助的な
役割をしていることが示唆された15,16)。
また、他の分類方法として、細胞表面抗原であるCD4とCD8の発現により、それぞれ免疫反応を調節するヘルパーT細胞と、
直接標的細胞に傷害を与えるキラーT細胞の2群に大別される。ヘルパーT細胞はさらに産生するサイトカインの種類により、
細胞性免疫の調節に関与するTh1細胞と、主にB細胞に作用するサイトカインを分泌し抗体産生を調節する液性免疫に関与する
Th2細胞とに分けられる17)。免疫反応が細胞性免疫が主になるのか、あるいは液性免疫が主になるのかは、活性化されるTh1細胞と
Th2細胞のバランスにより決定されると考えられている。結核菌に対する防御免疫は典型的な細胞性免疫であることから、
このTh1細胞への分化の機構、あるいはTh1細胞の作用機序を明らかにすることは、結核を防御する方法を考察する上で非常に
参考になるであろう。マウスの系においては、IFN-gあるいはIFN-g受容体遺伝子のノックアウトマウスを用い、Th1細胞が産生する
IFN-gが生体の抗結核活性を誘導するのに極めて重要であることが示されている18-21)。IFN-gは前述したように、マクロファージを
活性化することにより、マクロファージ内で様々な殺菌作用を持つ生理活性物質を産生するようになる。従って、
IFN-gは生体の抗結核菌活性にとってなくてはならないものである。これらの結果はマウスの実験モデル系から得られたものであるが、
ヒトの系においては、抗結核活性におけるIFN-gの作用は明らかにはなっていない。
CD8の抗結核免疫における機能に関しては、CD8の細胞表面上での構築に必要なb2-microglobulin遺伝子ノックアウトマウスの
実験結果より、抗結核免疫の主体をなすものではないが、補助的な役割を担っていることが示唆されている22)。
5.インターロイキン-12(IL-12)
1)IL-12の生理活性
ヘルパーT細胞は、前述したように細胞性免疫に関与するTh1細胞と液性免疫に関与するTh2細胞の2群に分けられる。
現在のところTh1細胞とTh2細胞とは細胞表面抗原による区別はできず、これら細胞の産生するサイトカインの種類により
分けられている(表1)。
表1 Th1細胞とTh2細胞により産生される
サイトカイン |
 |
すなわち、Th1細胞は、IL-2, IFN-g等細胞性免疫を高めるサイトカインを、Th2細胞はIL-4,
IL-5等B細胞の抗体産生を高めるサイトカインを産生する。このようなヘルパーT細胞の機能的な分化は、未分化状態のヘルパーT細胞
(Th0細胞)にそれぞれの分化を誘導するサイトカインが作用することによると考えられており、最近遺伝子クローニングされた
IL-12がTh1細胞の、またIL-4、IL-13がTh2細胞の分化に重要なサイトカインであることが明らかになってきた。IL-12は最初、
ナチュラルキラー(NK)細胞を活性化するサイトカインとしてヒトEBウイルストランスフォームB細胞株の培養上清より精製単離され、
そして遺伝子がクローニングされた23, 24)。その後、当初報告された活性だけでなく、他の免疫系細胞に広く作用を及ぼすことが
明らかになった25)。IL-12を産生する細胞種としては、最初に報告されたヒトEBウイルストランスフォームB細胞株以外に、
マクロファージ等が報告されており、生体内では主に細菌感染により刺激を受けたマクロファージからIL-12が産生されると
考えられている。このIL-12によりTh0細胞がTh1細胞に分化し(図2)、
|
図2 Th1細胞の分化 |
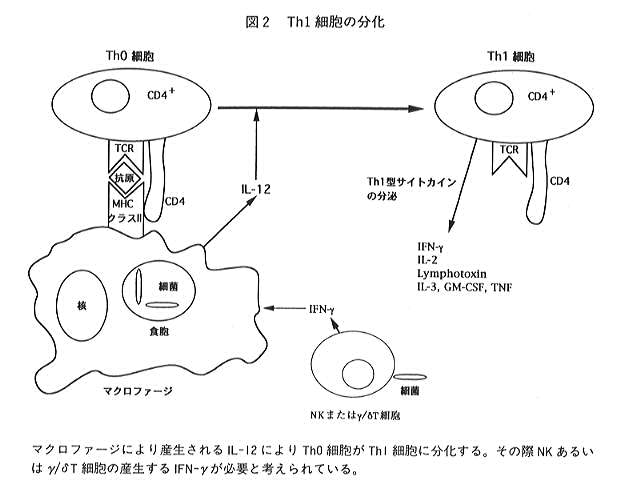 |
分化したTh1細胞が産生するIFN-gによりマクロファージが
活性化され感染した細菌を除去するように働くものと考えられている。
2)IL-12の物性
IL-12はその構造的にも、これまでのサイトカインとは異なる。通常サイトカインはモノマーあるいはホモダイマーから
構成されているが、IL-12はp40と呼ばれる分子量4万の蛋白質と、p35と呼ばれる分子量3万の蛋白質から構成される
ヘテロダイマーである。アミノ酸配列のホモロジー解析からは、p35はIL-6に、p40はIL-6受容体にそれぞれ類似しており、
IL-12は一つのサイトカインとその可溶性受容体とが結合したものから進化してきたサイトカインであると言うことができる。
IL-12産生細胞では、p35は恒常的に発現されているが、p40が誘導的に発現され、これらがヘテロダイマーを形成することにより
IL-12として活性を示す。
3)IL-12の細胞内情報伝達機構
IL-12がTh0細胞に作用しTh1細胞への分化を誘導するには、まずTh0細胞表面上に発現されている特異的なIL-12受容体にIL-12が
結合することにより、IL-12受容体からIL-12に特異的なシグナルが核内に伝達され、Th1細胞への分化に必要な一群の遺伝子の発現が
誘導されると考えられる(図3)。
|
図3 IL-12による細胞内情報伝達機構 |
 |
最初のIL-12受容体の遺伝子クローニングは1994年に報告されている26)。この受容体は、IL-12が
IL-6系と類似性があることから想像できるように、IL-6系受容体に使われているpg130と類似性を持つ。しかし、この受容体単独では
IL-12に対する親和性は低く、またIL-12非応答性細胞に発現させてもIL-12応答性細胞にはならない。さらにこの受容体の
細胞質内部位には細胞内情報伝達にとって重要な役割を持つと考えられているチロシン残基が存在しない。これらのことから、
機能的なIL-12受容体の構造は、このIL-12受容体単独では不十分であり、このIL-12受容体と未知のサブユニットとの複合体で
形成されていることが示唆された。昨年末、この未知のサブユニットの遺伝子クローニングが報告された27)。それによると新たに
クローニングされた受容体の構造は、やはりpg130と類似性を示し、先にクローニングされた受容体と共に発現させると、通常IL-12
応答性細胞で見られる高親和性受容体を形成し、さらにIL-12非応答性細胞に発現させるとIL-12応答性細胞に変化することが示された。
また、この受容体の細胞質内部位にはチロシン残基が存在し、多くのサイトカイン受容体に共通にみられる構造が存在する。
以上の結果から、IL-12の細胞内情報伝達における新たにクローニングされた受容体の重要性が推察される。機能的なIL-12受容体を
再構築できるようになったことから、今後IL-12の細胞内情報伝達機構の解明が進むものと期待できる。
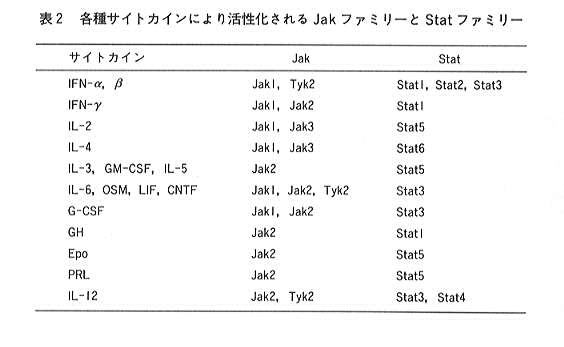
このIL-12に特異的な細胞内情報伝達機構については、既に幾らか重要な報告がされている。現在ほとんどのサイトカインの
細胞内情報伝達において、チロシンキナーゼの一群であるJakキナーゼ、およびこのJakキナーゼによりチロシン残基がリン酸化され
活性化される一群の転写因子であるStat(signal transducers and activators of transcription)と呼ばれるシグナル伝達分子が
関与していることが知られている28)(表2)。
|
表2 各種サイトカインにより活性化されるJakファミリーとStatファミリー |
 |
この機構は、一般的に次のように理解されている。まずサイトカインがその受容体に
結合することにより受容体の重合が誘導され、受容体に結合したJakキナーゼが活性化される。活性化されたJakキナーゼは、受容体の
チロシン残基をリン酸化する。リン酸化された受容体にStatが結合する。この時リン酸化されたチロシン残基のまわりのアミノ酸配列に
より結合するStatの種類が決定されると考えられている。さらに受容体結合Statは、Jakキナーゼによりリン酸化を受けることにより
受容体との結合よりもStat-Stat間の結合力が強くなり、Statの二量体あるいは複合体を形成する。このようなStatの二量体あるいは
複合体は核に移行し、それぞれ特異的なDNA塩基配列に結合することによりその下流にある遺伝子の発現を調節している。
現在、Jakキナーゼは4種類(Tyk2, Jak1, Jak2, Jak3)、Statは7種類(Stat1, Stat2, Stat3, Stat4, Stat5A, Stat5B, Stat6)
クローニングされており、それぞれのサイトカインは決められたJakキナーゼとStatを活性化する。IL-12に関しては、Tyk2, Jak229)
とStat3, Stat430)が活性化されることが報告されている。このStat4の活性化は現在までのところIL-12に特異的であることから、
Stat4の活性化が、Th1細胞への分化に極めて重要であることが想像される。実際、Stat4遺伝子を欠損したノックアウトマウスでは、
IL-12によるTh1細胞への分化が認められないことが報告されている31, 32)。今後Stat4によりどのような遺伝子の発現が誘導される
のか解析が進めば、Th0からTh1細胞への分化に必要な遺伝子が明らかになると考えられる。
4)Th細胞間の調節機構
Th1細胞の産生するIFN-gによりTh2細胞の機能が低下すること、逆にTh2細胞の産生するIL-4がTh1細胞の機能を
低下させることが報告されており33)、Th1細胞とTh2細胞は互いに制御しあっている。従って、Th2細胞が優位になればなるほど、
Th1細胞の機能は低下し、引いては抗結核免疫が低下することになる。このように、抗結核免疫を維持するためにはIL-12やIFN-g
産生の誘導、あるいはIL-4産生の抑制などTh1細胞を活性化し、Th2細胞を抑制することが考えられるが、過剰なTh1細胞の活性化は
結核病巣の壊死を引き起こすことが考えられ、人為的に免疫系を調節することは容易ではないことが予想される。
5)マクロファージによるIL-12産生の機序
マクロファージによるIL-12産生には、予めマクロファージがIFN-gによりある程度活性化されている必要があることが
報告されている34)。このIFN-gの由来は明らかではないが、NK細胞あるいはg/dT細胞により産生されていると考えられている。
NK細胞は非T非B細胞系の特殊なリンパ球であり、ある種の癌細胞やウイルス感染した細胞等の異常細胞を認識し破壊する。
g/dT細胞は前述したようにほとんどの上皮内に存在し、体表面での感染防御を司ると考えられている。これらの初期感染の
防御に関与する免疫細胞群が、結核菌感染の刺激によりIFN-gを産生すると考えられている。マクロファージはこのような
IFN-gによる刺激と、結核菌感染による刺激でIL-12を産生するようになると推察される。それでは、どのような刺激により
マクロファージからIL-12産生が誘導されるのであろうか。最近、貧食作用を誘導するだけでマクロファージからIL-12の
mRNA発現誘導が見られることが報告された35)。これによるとIL-12産生には特異性はなく、単にポリスチレンビーズを
貧食させてもIL-12産生が誘導されることが示唆された。マクロファージからのIL-12産生誘導が、この貧食作用による誘導のみで
説明が可能か否かは、今後さらに詳細な検討が必要と思われる。一方、特異的なIL-12産生を誘導する結核菌菌体成分が発見できれば、
これを成分ワクチンとして使用することも可能であろう。
6.生体の免疫能を惹起する結核菌菌体成分
結核菌の菌体成分が様々な免疫反応を引き起こすことは、数多く報告されている。結核菌の細胞表面は特徴的な脂質で覆われているが、
これらの脂質が免疫系に対し様々な生理活性を示すことは従来より知られていた。これらの中でも代表的なものとしては、cord factorと
上記のLAMがあげられるであろう36)。これらは非特異的に作用しIL-1、IL-6、TNF等の炎症性サイトカインの産生を誘導する。
一方、結核菌特異的な免疫反応は、結核菌由来の蛋白質により誘導される。古くはコッホのツベルクリンに始まり、現在では様々な
精製蛋白質による免疫反応の誘導が報告されている37)。現在結核の診断に用いられるPPDは、結核菌培養上清を硫安塩析したもので、
その中には数百種類もの蛋白質が混在しており、結核菌に特異的な蛋白質だけでなく、他の細菌と共通構造を持つ蛋白質も含まれる。
そのため、ツベルクリン反応は、必ずしも結核菌感染に特異的な反応を見ていることにはならない。
このように、より特異性の高い診断法を開発するためには、これらの精製蛋白質による免疫反応の解析は必須のものであろう。
抗結核免疫に関与する結核菌由来蛋白質の解析は、後述する新たな抗結核ワクチンの開発にとっても重要である。
7.これからの抗結核ワクチン
現在のところ抗結核ワクチンとして一般的に使用されているのは、唯一BCGだけである。しかし、BCGの効果については、
依然として議論されている。BCGは、最初の株から分けられた3株が世界的にワクチンとして使用されていが、株の分与以降それぞれ
個別の研究施設で維持保存されており、それらの菌の性質は異なってきている。抗結核免疫を誘導するのには生菌を接種する必要があるが、
BCGを凍結乾燥したBCGワクチンの菌の生存率は調製したワクチンごとに異なっていることが予想され、このようなワクチンを
用いているためBCGワクチンの評価が一定しないことも考えられる。また、BCGワクチンのように生菌を免疫力の弱まった人に
接種することは危険を伴うであろう。このように、BCGワクチンに取って変わる、より効果的で安全なワクチンの開発が望まれている。
新しい抗結核ワクチンとして、次のようなものが考えられている38)。まず、結核菌由来の蛋白質の中で、結核菌に対して強い
細胞性免疫を誘導しうる蛋白質を解析し、そのリコンビナント蛋白質をワクチンとして使用することが考えられる。あるいは、
このような蛋白質を発現するように遺伝子を組み込んだBCGを作製し、これをワクチンとして使用することも考えられる。また、
結核菌の病原遺伝子が解明されれば、その遺伝子を不活化させた結核菌を作製し、ワクチンにすることも考えられる。最近、
サイトカインを産生するリコンビナントBCGが作製され、これらを投与することにより免疫反応が高まることが報告された39)。
このように、これまで述べてきた結核菌とマクロファージとの関係、あるいは抗結核免疫の機構が分子レベルあるいは遺伝子レベルで
明らかにされるにつれ、より安全で効果的な抗結核ワクチンの開発が進むであろう。
8.おわりに
化学療法により劇的に結核の死亡率は低下してきたものの、結核は依然として感染症の中において、高い感染率と致死率を示している。
さらに現在、多剤耐性菌の出現やAIDS感染等により感染率および致死率の低下が鈍化する傾向が既に認められている。このように、
結核は過去の感染症ではなく、将来再び脅威の感染症になる可能性を秘めている。最近の分子生物学並びに免疫学の急速な発展により、
結核菌に対する防御機構が分子レベルで部分的ではあるが説明可能になりつつある。しかしながら、結核菌の病原遺伝子解析については
あまり進展がないように思われる。今後、抗結核菌防御機構並びに結核菌の遺伝子解析がさらに進み、病原遺伝子が解明されることにより、
従来にない論理的なワクチン開発がもたらされるであろうと期待される。
参考文献
1) Koch R : Die Atiologie der Tuberkulose, Berliner Klin Wochenschr, 19 : 221〜230, 1882.
2) Koch R : Weitere Mitteilungen uber das Tuberkulin, Dtsch Med Wochenschr, 43 : 1189〜1192, 1891.
3) Greenwood M : Professor Calmette's statistical study of BCG vaccination, Br Med J, 1 : 793〜795, 1928.
4) Chase MW : The cellular transfer of cutaneous hypersensitivity to tuberculin, Proc Soc Exp Biol Med, 59 : 134〜135, 1945.
5) Schlesinger LS et al : Phagocytosis of Mycobacterium tuberculosis is mediated by human monocyte complement receptors and complement component C3, J Immunol, 144 : 2771〜2780, 1990.
6) Schlesinger LS : Macrophage phagocytosis of virulent but not attenuated strains of Mycobacterium tuberculosis is mediated by mannose receptors in addition to complement receptors, J Immunol, 150 : 2920〜2930, 1993.
7) Gordon AH et al : Ammonia inhibits phagosome-lysosome fusion in macrophages, Nature, 286 : 79〜81, 1980.
8) D'Arcy Hart P et al : Chemical inhibitors of phagosome-lysosome fusion in cultured macrophages also inhibit saltatory lysosomal movements. A combined microscopic and computer study, J Exp Med, 158 : 477〜492, 1983.
9) Goren MB et al : Prevention of phagosome-lysosome fusion in cultured macrophages by sulfatides of Mycobacterium tuberculosis, Proc Natl Acad Sci USA, 73 : 2510〜2514, 1976.
10) Vachula M et al : Suppression of monocyte oxidative response by phenolic glycolipid I of Mycobacterium leprae, J Immunol, 142 : 1696〜1701, 1989.
11) Brozna JP et al : Monocyte response to sulfatide from Mycobacterium tuberculosis : inhibition of priming for enhanced release of superoxide, associated with increased secretion of interleukin-1 and tumor necrosis factor alpha, and altered protein phosphorylation, Infect Immun, 59 : 2542〜2548, 1991.
12) Chan J et al : Microbial glycolipids : possible virulence factors that scavenge oxygen radicals, Proc Natl Acad Sci USA, 86 : 2453〜2457, 1989.
13) Nathan CF・Hibbs Jr JB : Role of nitric oxide synthesis in macrophage antimicrobial activity, Curr Opin Immunol, 3 : 65, 1991.
14) King C et al : Expression of contact-dependent cytolytic activity of Mycobacterium tuberculosis and isolation of the locus encoding the activity, Infect Immun, 61 : 2708〜2712, 1993.
15) Ladel CH et al : Contribution of a/b and g/d T lymphocytes to immunity against Mycobacterium bovis Bacillus Calmette Guerin : studies with T cell-receptor-deficient mutant mice, Eur J Immunol, 25 : 838〜846,1995.
16) Ladel CH : Protective role of g/d T cells and a/b T cells in tuberculosis, Eur J Immunol, 25 : 2877〜2881, 1995.
17) Mosmann TR・Coffman RL : TH1 and TH2 cells : different patterns of lymphokine secretion lead to different functional properties, Annu Rev Immunol, 7 : 145〜173,1989.
18) Dalton D et al : Multiple defects of immune cell function in mice with disrupted interferon-g genes, Science, 259 : 1739〜1742, 1993.
19) Flynn JL et al : An essential role for IFN-g in resistance to Mycobacterium tuberculosis infection, J Exp Med, 178 : 2249〜2254, 1993.
20) Cooper AM et al : Disseminated tuberculosis in interferon-g gene-disrupted mice, J Exp Med, 178 : 2243〜2247, 1993.
21) Kamijo R et al : Mice that lack the interferon-g receptor have profoundly altered responses to infection with Bacillus Calmette-Guerin and subsequent challenge with lipopolysaccharide, J Exp Med, 178 : 1435〜1440, 1993.
22) Flynn JL et al : Major histocompatibility complex class I-restricted T cells are required for resistance to Mycobacterium tuberculosis infection, Proc Natl Acad Sci USA, 89 : 12013〜12017, 1992.
23) Gubler U et al : Coexpression of two distinct genes is required to generate secreted bioactive cytotoxic lymphocyte maturation factor, Proc Natl Acad Sci USA, 88 : 4143〜4147, 1991.
24) Wolf SF et al : Cloning of cDNA for natural killer cell stimulatory factor, a heterodimeic cytokine with multiple biologic effects on T and natural killer cells, J Immunol, 146, 3074〜3081, 1991.
25) Trinchieri G : Interleukin-12: a proinflammatory cytokine with immunoregulatory functions that bridge innate resistance and antigen-specific adaptive immunity, Annu Rev Immunol, 13 : 251〜276, 1995.
26) Chua AO et al : Expression cloning of a human IL-12 receptor component: a new member of the cytokine receptor superfamily with strong homology to gp130, J Immunol, 153 : 128〜136, 1994.
27) Presky DH et al : A functional interleukin 12 receptor complex is composed of two b-type cytokine receptor subunits, Proc Natl Acad Sci USA, 93 : 14002〜14007, 1996.
28) Ihle JN・Kerr IM : Jaks and Stats in signaling by the cytokine receptor superfamily, TIG, 11 : 69〜74, 1995.
29) Bacon CM et al : Interleukin 12 (IL-12) induces tyrosine phosphorylation of JAK2 and TYK2: differential use of Janus family tyrosine kinases by IL-2 and IL-12, J Exp Med, 181 : 399〜404, 1995.
30) Jacobson NG et al : Interleukin 12 signaling in T helper type 1 (Th1) cells involves tyrosine phosphorylation of signal transducer and activator of transcription (Stat)3 and Stat4, J Exp Med, 181 : 1755〜1762, 1995.
31) Thierfelder WE et al : Requirement for Stat4 in interleukin-12-mediated responses of natural killer and T cells, Nature, 382 : 171〜174, 1996.
32) Kaplan MH et al : Impaired IL-12 responses and enhanced development of Th2 cells in Stat4-deficient mice, Nature, 382 : 174〜177, 1996.
33) Maggi E et al : Reciprocal regulatory effects of IFN-g and IL-4 on the in vitro development of human Th1 and Th2 clones, J Immunol, 148 : 2142〜2147, 1992.
34) Flesch IEA et al : Early interleukin 12 production by macrophages in response to mycobacterial infection depends on interferon g and tumor necrosis factor a, J Exp Med, 181 : 1615〜1621, 1995.
35) Fulton AS et al : Interleukin-12 production by human monocytes infected with Mycobacterium tuberculosis: role of phagocytosis, Infect Immun, 64 : 2523〜2531, 1996.
36) Besra GS・Chatterjee D : Lipid and Carbohydrates of Mycobacterium tuberculosis. in Tuberculosis-Pathogenesis, Protection, and Control (ed. by BR Bloom), ASM Press, Washington, 285〜306, 1994.
37) 光山正雄:抗結核防御免疫の誘導と発現機構、資料と展望、18 : 1〜13, 1996.
38) Bloom BR・Fine PEM: The BCG experience : implications for future vaccines against tuberculosis. in Tuberculosis-Pathogenesis, Protection, and Control (ed. by BR Bloom), ASM Press, Washington, 531〜557, 1994.
39) Murray PJ et al : Manipulation and potentiation of antimycobacterial immunity using recombinant bacille Calmette-Guerin strains that secrete cytokines, Proc Natl Acad Sci USA, 93 : 934〜939, 1996.�
(出典)原田登之: 抗結核防御の免疫機構, 資料と展望, 21:1〜11, 1997
|